Apuntes Teóricos-
Plan trimestral del III trimestre para 10°
I. La tabla periódica y sus antecedentes históricos.
A.- Utilización de la Configuración electrónica para la ubicación de los elementos en la tabla periódica
A.1- Elementos Representativos o Familia A de la tabla periódica
A.1.1-Elementos pertenecientes al bloque S
A.1.2- Elementos pertenecientes al bloque P
A.2- Elementos de transición
A.2.1 Elementos pertenecientes al bloque D
A.3- Elementos de transición interna
A.3.1- Elementos pertenecientes al bloque F
B.- Grupos o familias de la tabla periódica de acuerdo a los bloques de subniveles
B.1- Bloque S
B.1.1 Elementos Alcalinos
B.1.2 Elementos alcalinotérreos
B.2. Bloque D
B.2.1- Familia B de la tabla periódica
B.3- Bloque P
B.1- Elementos boroides
B.2-Elementos carbonoides
B.3- Elementos nitrogenoides
B.4-Elementos Oxigenoides o calcógenos
B.5- Elementos Halógenos
B.6-Elementos nobles (gases)
C.- Propiedades de los átomos y su relación con sus ubicaciones en la tabla periódica actual.
C.1- Radio atómico e iónico
C.2- Electronegatividad
C.2.1- Orden de electronegatividad de los elementos
C.3- Energía de ionización,
C.4- Afinidad electrónica
C.5- Elementos representativos
C.6- de transición y de transición interna.
C.7- Elementos metálicos, no metálicos y metaloides.
II.- El enlace químico
A.- Definición
A.1- Relación entre enlace químico y los electrones de valencia
A.2- Símbolos de Lewis
A.3- Regla del Octeto y Regla del Duplete.
A.4- Clasificación del enlace químico.
A.4.1 Enlace iónico
A.4.2- Enlace co- Valente
A.4.3- Enlace electro Valente
A.4.3- Enlace metálico
A.- 4.4 Enlace molecular
Desarrollo
I. La tabla periódica y sus antecedentes históricos.
A.- Utilización de la Configuración electrónica para la ubicación de los elementos en la tabla periódica
Utilización para la ubicación de los elementos en la tabla periódica: En física y química, la configuración electrónica indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un producto de orbitales antisimetrizadas. La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.

A.1- Elementos Representativos o Familia A de la tabla periódica
los elementos representativos o elementos de los grupos principales son elementos químicos de los grupos largos de la tabla periódica, encabezados por los elementos hidrógeno,litio berilio, sodio, magnesio, potasio, calcio, rubidio, estroncio, cesio, bario,francio y radio tal como aparecen en la tabla periódica de los elementos. Se caracterizan por presentar configuraciones electrónicas "externas" en su estado fundamental que van desde ns1hasta ns2np6, a diferencia de los elementos de transición y de los elementos de transición interna.
A.1.1-Elementos pertenecientes al bloque S

A.1.2- Elementos pertenecientes al bloque P
z nombre simbolo
5 Boro B
6 Carbono C
7 Nitrógeno N
8 Oxígeno O
9 Flúor F
10 Neón Ne
13 Aluminio Al
14 Silicio Si
15 Fósforo P
16 Azufre S
17 Cloro Cl
18 Argón Ar
31 Galio Ga
32 Germanio Ge
33 Arsénico As
34 Selenio Se
35 Bromo Br
36 Cripton Kr
49 Indio In
50 Estaño Sn
51 Antimonio Sb
52 Teluro Te
53 Yodo I
54 Xenón Xe
81 Talio Tl
82 Plomo Pb
83 Bismuto Bi
84 Polonio P
85 Ástato At
86 Radón Rn
113 Ununtrio Uut
114 Flerovio Fl
115 Ununpentio Uup
116 Livermorio Lv
117 Ununseptio Uus
118 Ununoctio Uuo
A.2- Elementos de transición
Son aquellos que poseen una estructura electrónica con orbitales d o f parcialmente ocupados. Dentro de ellos se suelen separar los e. de transición interna o elementos f, dejando como típicos e. de transición los que tienen sus electrones diferenciadores en orbitales d
A.2.1 Elementos pertenecientes al bloque D
|
Z |
Nombre |
Símbolo |
|
21 |
Escandio |
Sc |
|
22 |
Titanio |
Ti |
|
23 |
Vanadio |
V |
|
24 |
Cromo |
Cr |
|
25 |
Manganeso |
Mn |
|
26 |
Hierro |
Fe |
|
27 |
Cobalto |
Co |
|
28 |
Níquel |
Ni |
|
29 |
Cobre |
Cu |
|
30 |
Cinc |
Zn |
|
39 |
Itrio |
Y |
|
40 |
Circonio |
Zr |
|
41 |
Niobio |
Nb |
|
42 |
Molibdeno |
Mo |
|
43 |
Tecnecio |
Tc |
|
44 |
Rutenio |
Ru |
|
45 |
Rodio |
Rh |
|
46 |
Paladio |
Pd |
|
47 |
Plata |
Ag |
|
48 |
Cadmio |
Cd |
|
71 |
Lutecio |
Lu |
|
72 |
Hafnio |
Hf |
|
73 |
Tantalio |
Ta |
|
74 |
Wolframio |
W |
|
75 |
Renio |
Re |
|
76 |
Osmio |
Os |
|
77 |
Iridio |
Ir |
|
78 |
Platino |
Pt |
|
79 |
Oro |
Au |
|
80 |
Mercurio |
Hg |
|
103 |
Lawrencio |
Lr |
|
104 |
Rutherfordio |
Rf |
|
105 |
Dubnio |
Db |
|
106 |
Seaborgio |
Sg |
|
107 |
Bohrio |
Bh |
|
108 |
Hasio |
Hs |
|
109 |
Meitnerio |
Mt |
|
110 |
Darmstadtio |
Ds |
|
111 |
Roentgenio |
Rg |
|
112 |
Copernicio |
Cn |
A.3- Elementos de transición interna
son Los elementos o metales de transición, situados en los bloques d y f de la tabla periódica. Se componen por Los lantánidos y actínidos, en los cuales se comienza a llenar un orbital f se consideran también de transición, pero para distinguirlos de los del bloque d (de transición o de transición externa) se les suele denominar elementos de transición interna o tierras raras.

A.3.1- Elementos pertenecientes al bloque F
Son dos series, una comenzando a partir del elemento lantano y la otra a partir del actinio, y por eso a los elementos de estas series se les llama lantánidos y actínidos. Aunque en la tabla periódica de los elementos tendrían que estar después de esos dos elementos, se suelen representar separados del resto. También se conocen los Lantánidos como tierras raras.
|
Z |
Nombre |
Símbolo |
|
57 |
Lantano |
La |
|
58 |
Cerio |
Ce |
|
59 |
Praseodimio |
Pr |
|
60 |
Neodimio |
Nd |
|
61 |
Prometio |
Pm |
|
62 |
Samario |
Sm |
|
63 |
Europio |
Eu |
|
64 |
Gadolinio |
Gd |
|
65 |
Terbio |
Tb |
|
66 |
Disprosio |
Dy |
|
67 |
Holmio |
Ho |
|
68 |
Erbio |
Er |
|
69 |
Tulio |
Tm |
|
70 |
Iterbio |
Yb |
|
89 |
Actinio |
Ac |
|
90 |
Torio |
Th |
|
91 |
Protactinio |
Pa |
|
92 |
Uranio |
U |
|
93 |
Neptunio |
Np |
|
94 |
Plutonio |
Pu |
|
95 |
Americio |
Am |
|
96 |
Curio |
Cm |
|
97 |
Berkelio |
Bk |
|
98 |
Californio |
Cf |
|
99 |
Einstenio |
Es |
|
100 |
Fermio |
Fm |
|
101 |
Mendelevio |
Md |
|
102 |
Nobelio |
No |
B.- Grupos o familias de la tabla periódica de acuerdo a los bloques de subniveles
Considerando el ultimo subnivel en la distribución electrónica de los elementos, éstos se clasifican en cuatro bloques (s, p, d, f) lo que permite identificar al grupo al cual pertenece cada elemento. El elemento cuya configuración electrónica termina en subnivel “s” o “p” es representativo (grupo A), si la configuración electrónica termina en subnivel “d” es un elemento de transición (grupo B), y si la configuración electrónica termina en “f”, es un elemento de transición interna o tierra rara (grupo IIIB).
B.1- Bloque S
|
Z |
Nombre |
Símbolo |
|
1 |
Hidrógeno |
H |
|
2 |
Helio |
He |
|
3 |
Litio |
Li |
|
4 |
Berilio |
Be |
|
11 |
Sodio |
Na |
|
12 |
Magnesio |
Mg |
|
19 |
Potasio |
K |
|
20 |
Calcio |
Ca |
|
37 |
Rubidio |
Rb |
|
38 |
Estroncio |
Sr |
|
55 |
Cesio |
Cs |
|
56 |
Bario |
Ba |
|
87 |
Francio |
Fr |
|
88 |
Radio |
Ra |
B.1.1 Elementos Alcalinos
Son los seis elementos situados en el grupo 1A de la tabla periódica (excepto el hidrógeno que es un gas). El grupo incluye litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs), francio (Fr). Cada uno tiene solo un electrón en su nivel energético más externo, con tendencia a perderlo (esto es debido a que tienen poca afinidad electrónica, y baja energía de ionización), con lo que forman un ion monopositivo, M+. Presentan densidades muy bajas y son buenos conductores de calor y la electricidad; reaccionan de inmediato con el agua, oxígeno y otras substancias químicas, y nunca se les encuentra como elementos libres (no combinados) en la naturaleza. Los compuestos típicos de los metales alcalinos son solubles en agua y están presentes en el agua de mar y en depósitos salinos. Como estos metales reaccionan rápidamente con el oxígeno, se venden en recipientes al vacío, pero por lo general se almacenan bajo aceite mineral queroseno. La configuración electrónica del grupo 1 o los metales alcalinos es ns¹. Por ello se dice que se encuentran en la zona "s" de la tabla periódica.
B.1.2 Elementos alcalinotérreos
Son un grupo de elementos que se encuentran situados en el grupo IIA de la tabla periódica y son los siguientes: berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra). Este último no siempre se considera, pues tiene un tiempo de vida media corta.
El nombre «alcalinotérreos» proviene del nombre que recibían sus óxidos, «tierras», que tienen propiedades básicas (alcalinas). Poseen una electronegatividad ≤ 1,57 según la escala de Pauling.
Características: son más duros que los metales alcalinos, tienen brillo y son buenos conductores eléctricos; menos reactivos que los alcalinos, buenos agentes reductores y forman compuestos iónicos. Todos ellos tienen dos (2) electrones en su capa mas externa (electrones de valencia).
|
2 |
4 Be |
|
3 |
12 Mg |
|
4 |
20 Ca |
|
5 |
38 Sr |
|
6 |
56 Ba |
|
7 |
88 Ra |
B.2. Bloque D
En el diagrama se muestra la tabla periódica dividida en bloques. En el bloque d hay treinta elementos (realmente hay más, pero no se encuentran en la naturaleza y no se suelen tener en cuenta). Éstos se dividen en diez grupos de tres (las columnas), en donde los tres elementos tienen propiedades físicas y químicas parecidas entre sí, aunque los dos que se encuentran más abajo se parecen más entre sí y muestran más diferencias con el que está en la primera fila (llamado normalmente "elemento cabecera de grupo").
|
Z |
Nombre |
Símbolo |
|
21 |
Escandio |
Sc |
|
22 |
Titanio |
Ti |
|
23 |
Vanadio |
V |
|
24 |
Cromo |
Cr |
|
25 |
Manganeso |
Mn |
|
26 |
Hierro |
Fe |
|
27 |
Cobalto |
Co |
|
28 |
Níquel |
Ni |
|
29 |
Cobre |
Cu |
|
30 |
Cinc |
Zn |
|
39 |
Itrio |
Y |
|
40 |
Circonio |
Zr |
|
41 |
Niobio |
Nb |
|
42 |
Molibdeno |
Mo |
|
43 |
Tecnecio |
Tc |
|
44 |
Rutenio |
Ru |
|
45 |
Rodio |
Rh |
|
46 |
Paladio |
Pd |
|
47 |
Plata |
Ag |
|
48 |
Cadmio |
Cd |
|
71 |
Lutecio |
Lu |
|
72 |
Hafnio |
Hf |
|
73 |
Tantalio |
Ta |
|
74 |
Wolframio |
W |
|
75 |
Renio |
Re |
|
76 |
Osmio |
Os |
|
77 |
Iridio |
Ir |
|
78 |
Platino |
Pt |
|
79 |
Oro |
Au |
|
80 |
Mercurio |
Hg |
|
103 |
Lawrencio |
Lr |
|
104 |
Rutherfordio |
Rf |
|
105 |
Dubnio |
Db |
|
106 |
Seaborgio |
Sg |
|
107 |
Bohrio |
Bh |
|
108 |
Hasio |
Hs |
|
109 |
Meitnerio |
Mt |
|
110 |
Darmstadtio |
Ds |
|
111 |
Roentgenio |
Rg |
|
112 |
Copernicio |
Cn |
B.2.1- Familia B de la tabla periódica
Los metales de transición se localizan en la parte central de la tabla periódica y se les identifica con facilidad mediante un numero romano seguido de la letra "b" en muchas tablas. No hay que olvidar, sin embargo, que ciertas tablas periódicas emplean un sistema distinto de rótulos, en el que los primeros grupos de metales de transición están marcados como grupos "a" y los dos últimos grupos de metales de transición se identifican como grupos "b". Otras tablas no emplean la designación de "a" o "b".
En general, las propiedades de los metales de transición son bastantes similares. Estos metales son más quebradizos y tienen puntos de fusión y ebullición más elevados que los otros metales. Las densidades, puntos de fusión y puntos de ebullición de los metales de transición aumentan primero y luego disminuyen dentro de cada periodo, conforme aumenta el número atómico. Esta tendencia es más notoria en los metales de transición del sexto periodo. Los metales de transición son muchos menos reactivos que los metales alcalinos y alcalinotérreos. Así, aunque los metales alcalinos, como el sodio o el potasio, nunca se encuentran libres en la naturaleza, si se ha podido encontrar muestras relativamente puras de varios metales de transición, como oro, plata, hierro y manganeso.
Los metales de transición pueden perder dos electrones de valencia del subnivel s más externo, además de electrones d retenidos con poco fuerza en el siguiente nivel energético más bajo. Así un metal de transición en particular, puede perder un número variable de electrones para formar iones positivos con cargas distintas. Por ejemplo, el hierro pueden formar el ion fe2+ o el ino fe3+ se dice que el hierro tienen números de oxidación +2 y +3. Muchos compuestos de metales de transición presentan un colorido brillante gracias a un número variable de electrones no aparados.
el cobre, la plata y el oro se les llama metales de acuñación. Los tres son buenos conductores de calor y electricidad. el cobre tiene un color rojizo característico, que poco a poco se oscurece conforme reacciona el metal con el oxigeno y los compuestos de azufre del aire. el cobre se emplea de manera extensa en aplicaciones eléctricas, monedas, tubería para agua y en aleaciones muy conocidas como el latón, el bronce y la plata Stirling.
Estos elementos conforman los grupos IB hasta el VIIIB. Todos ellos son metales, pero debido a que sus átomos son pequeños, son duros, quebradizos y tienen puntos de fusión altos. Estos metales son buenos conductores del calor y de la electricidad. A condiciones normales el Mercurio es líquido.
Los elementos de transición llenan progresivamente su tercer nivel de energía hasta completarlo con 18 electrones; algunos de los elementos también ocupan el nivel 3d. Con excepción del Cromo y del Cobre, todos tienen dos electrones en el cuarto nivel (4s). Esta irregularidad ocurre en esos dos elementos ya que los sub niveles llenos y semillenos poseen una estabilidad adicional.
Los elementos del grupo B presentan varios estados de oxidación. Esto se debe a que todos los electrones de los niveles 3d y 4s los utilizan para formar enlaces químicos.
El Hierro, la Plata, el Cobre y el Oro, son elementos de transición que presentan características diferentes de los demás elementos que conforman la familia. Por eso son analizados por separado.
El Hierro se encuentra de formas múltiples en la naturaleza formando distintas aleaciones con otros elementos. Cuando el Hierro es puro, es casi blanco, compacto y blando. Químicamente es un metal muy activo y funciona con estados de oxidación +2 y +3. Cuando se expone a la humedad o al aire forma un óxido férrico hidratado. Por sus propiedades físicas, el Hierro es utilizado en la fabricación de herramientas y gran variedad de equipos.
En la naturaleza el Cobre se encuentra libre y combinado. Es un metal rojizo, lustroso, maleable y es gran conductor tanto del calor como de la electricidad. El estado de oxidación cuando forma compuestos es +1 y +2. Por la gran cantidad de usos que se le pueden dar, el Cobre es considerado como el segundo metal en importancia después del Hierro. El Cobre entra en la producción de muchas aleaciones en la que aporta resistencia, dureza, resistencia a la corrosión y propiedades valiosas para trabajos mecánicos.
La Plata se encuentra en la naturaleza en estado metálico y es el más blanco de todos los metales. Después del Oro, la Plata es el metal mas maleable y dúctil de los metales y es el mejor conductor de la electricidad. Cuando forma compuestos su número de oxidación es +1. Principalmente es utilizado en la fabricación de monedas y en la puntas de los instrumentos eléctricos.
En la naturaleza el Oro se encuentra libre. En estado masivo es amarillo, pero en forma pulverizada es bronceado. Es el más maleable y más dúctil de todos los metales. Es blando y se considera como uno de los más inertes. En estado de oxidación +1 forma compuestos aurosos y cuando su oxidación es +3 forma compuestos áuricos. El Oro se utiliza en el trabajo de la orfebrería de joyas y ornamentos. Su pureza es medida en Kilates o en grados de ley.
B.3- Bloque P
Son aquellos situados en los grupos 3a 8a de la tabla periódica de los elementos. En estos elementos el nivel energético más externo corresponde a orbitales p (véase la configuración electrónica). La configuración electrónica externa de estos elementos es: ns²npx (x=1 a 6, siendo 1 para el primer grupo, 2 para el segundo, etc.)
Elementos del bloque p
|
Z |
Nombre |
Símbolo |
|
5 |
Boro |
B |
|
6 |
Carbono |
C |
|
7 |
Nitrógeno |
N |
|
8 |
Oxígeno |
O |
|
9 |
Flúor |
F |
|
10 |
Neón |
Ne |
|
13 |
Aluminio |
Al |
|
14 |
Silicio |
Si |
|
15 |
Fósforo |
P |
|
16 |
Azufre |
S |
|
17 |
Cloro |
Cl |
|
18 |
Argón |
Ar |
|
31 |
Galio |
Ga |
|
32 |
Germanio |
Ge |
|
33 |
Arsénico |
As |
|
34 |
Selenio |
Se |
|
35 |
Bromo |
Br |
|
36 |
Cripton |
Kr |
|
49 |
Indio |
In |
|
50 |
Estaño |
Sn |
|
51 |
Antimonio |
Sb |
|
52 |
Teluro |
Te |
|
53 |
Yodo |
I |
|
54 |
Xenón |
Xe |
|
81 |
Talio |
Tl |
|
82 |
Plomo |
Pb |
|
83 |
Bismuto |
Bi |
|
84 |
Polonio |
Po |
|
85 |
Ástato |
At |
|
86 |
Radón |
Rn |
|
113 |
Ununtrio |
Uut |
|
114 |
Flerovio |
Fl |
|
115 |
Ununpentio |
Uup |
|
116 |
Livermorio |
Lv |
|
117 |
Ununseptio |
Uus |
|
118 |
Ununoctio |
Uuo |
B.1- Elementos boroides
El grupo del boro, elementos térreos, boroides o boroideos es una serie de elementos que están situados en el grupo 13 de la tabla periódica de los elementos. Su nombre proviene de Tierra, ya que el aluminio es el elemento más abundante en ella, llegando a un 7.5%. Tienen tres electrones en su nivel energético más externo. Su configuración electrónica es ns2np1.
El primer elemento del grupo 13 es el boro(B) (aunque también se lo conoce como grupo del aluminio por su concurrido uso en la actualidad), un metaloide con un punto de fusión muy elevado y en el que predominan las propiedades no metálicas. Los otros elementos que comprenden este grupo son: aluminio(Al), galio (Ga), indio (In), y talio(Tl), que forman iones con una carga triple positiva (3+), salvo el talio que lo hace con una carga mono positiva (1+).
La característica del grupo es que los elementos tienen tres electrones en su capa más externa, por lo que suelen formar compuestos en los que presentan un estado de oxidación +3. El talio difiere de los demás en que también es importante su estado de oxidación +1. Esta baja reactividad del par de electrones es conforme se baja en el grupo se presenta también en otros grupos, se denomina efecto del par inerte y se explica considerando que al bajar en el grupo las energías medias de enlace van disminuyendo.

B.2-Elementos carbonoides
El grupo 14 de la tabla periódica de los elementos (antiguo grupo IV A), también conocido como grupo del carbono o de los carbonoideos, está formado por los siguientes elementos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn) y plomo (Pb).
La mayoría de los elementos de este grupo son muy conocidos y difundidos, especialmente el carbono, elemento fundamental de la química orgánica. A su vez, el silicio es uno de los elementos más abundantes en la corteza terrestre (28%), y de gran importancia en la sociedad a partir del siglo XX, ya que es el elemento principal de los circuitos integrados.
Al bajar en el grupo, estos elementos van teniendo características cada vez más metálicas: el carbono es un no metal, el silicio y el germanio son semimetales, y el estaño y el plomo son metales.

B.3- Elementos nitrogenoides
Cuando hablamos de nitrogenoides, estamos haciendo referencia a los elementos que acompañan al nitrógeno en el grupo 15 de la tabla periódica de los elementos, es decir, la familia del nitrógeno.
Seguramente, la característica que más destaca dentro la familia del nitrógeno, es que en este grupo encontramos tanto elementos que tienen propiedades metálicas, como también otros elementos con propiedades no metálicas, encontrándose diferencias de propiedades más significativas que en otros grupos de la tabla. Las configuraciones electrónicas que presentan los elementos hacen una ligera mención de estas características metálicas o no metálicas. Además hay que destacar, que en esta familia conviven dos elementos que podemos decir sean los más diversos entre sí, éstos son el poco reactivo di nitrógeno y el elemento reactivo, fósforo.
Las configuraciones electrónicas que presentan los diferentes elementos de este grupo en su capa externa es del tipo ns2np3 (encontrándose llena la capa ns2 y medio llena la capa np3), lo que les otorga una muy buena estabilidad. La estabilidad se hace patente al ver las altas energías de ionización que poseen los elementos de este grupo con respecto a otros grupos cercanos. La configuración electrónica que los caracteriza proporciona diversas posibilidades en cuanto a la formación de estables compuestos se refiere.

B.4-Elementos Oxigenoides o calcógenos
El grupo de los anfígenos o calcógenos es también llamado familia del oxígeno y es el grupo conocido antiguamente como VI A, y actualmente grupo 16 (según la IUPAC) en la tabla periódica de los elementos, formado por los siguientes elementos: oxígeno (O), azufre (S), selenio (Se), telurio (Te) y polonio (Po). El nombre de anfígeno en español deriva de la propiedad de algunos de sus elementos de formar compuestos con carácter ácido o básico.
Aunque todos ellos tienen seis electrones de valencia (última capa s2p4),1 sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta su número atómico.
El oxígeno y el azufre se utilizan abiertamente en la industria y el telurio y el selenio en la fabricación de semiconductores. Para adquirir la configuración electrónica de octeto típica de un gas noble, estos elementos deben aceptar un par de electrones, por lo que generalmente presentan estados de oxidación negativo, aunque al descender en el grupo los potenciales de ionización son más pequeños y se presentan también estados de oxidación positivos más típicos de los metales. El oxígeno existe abundantemente en la tierra, en el aire y combinado en el agua, formando óxidos, hidróxidos y algunas sales. El azufre también se presenta en abundancia, tanto en estado elemental como combinado. El selenio y el telurio se encuentran libres y combinados, aunque con menos abundancia. Finalmente, el polonio es un elemento radiactivo que se encuentra escasamente presente en la naturaleza, en forma de sales. Este grupo de elementos también se combina con algunos metales formando calcogenuros.

B.5- Elementos Halógenos
Los halógenos (del griego, formador de sales) son los elementos químicos que forman el grupo 17 (XVII A, utilizado anteriormente) o grupo VII A de la tabla periódica: flúor(F), cloro(Cl), bromo(Br), yodo(I), ástato(At) y ununseptio(Uus). Este último también está en los metales del bloque f.
En estado natural se encuentran como moléculas diatómicas químicamente activas [X2]. Para llenar por completo su último nivel energético (s2p5) necesitan un electrón más, por lo que tienen tendencia a formar un ion mono negativo, X-. Este ion se denomina haluros; las sales que lo contienen se conocen como haluros. Poseen una electronegatividad ≥ 2,5 según la escala de Pauling, presentando el flúor la mayor electronegatividad, y disminuyendo ésta al bajar en el grupo. Son elementos oxidantes (disminuyendo esta característica al bajar en el grupo), y el flúor es capaz de llevar a la mayor parte de los elementos al mayor estado de oxidación.
Muchos compuestos orgánicos sintéticos, y algunos naturales, y que contienen halógenos; a estos compuestos se les llama compuestos halogenuros. La hormona tiroidea contiene átomos de yodo. Los cloruros tienen un papel importante en el funcionamiento del cerebro mediante la acción del neurotransmisor inhibidor de la transmisión GABA (ácido gamma-amino butírico).

B.6-Elementos nobles (gases)
Los gases nobles son un grupo de elementos químicos con propiedades muy similares: por ejemplo, bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja. Se sitúan en el grupo 18 (VIIIA) 1 de la tabla periódica (anteriormente llamado grupo 0). Los siete gases son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), el radiactivo radón (Rn) y ununoctio (Uuo).
Las propiedades de los gases nobles pueden ser explicadas por las teorías modernas de la estructura atómica: a su capa electrónica de electrones valentes se la considera completa, dándoles poca tendencia a participar en reacciones químicas, por lo que solo unos pocos compuestos de gases nobles han sido preparados hasta 2008. El xenón reacciona de manera espontánea con el flúor (debido a la alta electronegatividad de éste), y a partir de los compuestos resultantes se han alcanzado otros. También se han aislado algunos compuestos con kriptón. Los puntos de fusión y de ebullición de cada gas noble están muy próximos, difiriendo en menos de 10 C°; consecuentemente, solo son líquidos en un rango muy pequeño de temperaturas.

C.- Propiedades de los átomos y su relación con sus ubicaciones en la tabla periódica actual.
C.1- Radio atómico e iónico
El radio iónico es, al igual que el radio atómico, la distancia entre el centro del núcleo del átomo y el electrón estable más alejado del mismo, pero haciendo referencia no al átomo, sino al ion. Éste aumenta en la tabla de izquierda a derecha por los periodos y de arriba hacia abajo en los grupos.
En el caso de los cationes, la ausencia de uno o varios electrones disminuye la fuerza eléctrica de repulsión mutua entre los electrones restantes, provocando el acercamiento de los mismos entre sí y al núcleo positivo del átomo del que resulta un radio iónico menor que el atómico.
En el caso de los aniones, el fenómeno es el contrario, el exceso de carga eléctrica negativa obliga a los electrones a alejarse unos de otros para restablecer el equilibrio de fuerzas eléctricas, de modo que el radio iónico es mayor que el atómico

C.2- Electronegatividad
La electronegatividad es una medida de la capacidad de un átomo (o de manera menos frecuente de un grupo funcional) para atraer a los electrones, cuando forma un enlace químico en una molécula[ ]También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en una especie molecular como en sistemas o especies no moleculares. El flúor es el elemento con más electronegatividad, el Francio es el elemento con menos electronegatividad.
La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes: su masa atómica y la distancia promedio de los electrones de valencia con respecto al núcleo atómico. Esta propiedad se ha podido correlacionar con otras propiedades atómicas y moleculares. Fue Linus Pauling el investigador que propuso esta magnitud por primera vez en el año 1932, como un desarrollo más de su valencia. La electronegatividad no se puede medir experimentalmente de manera directa como, por ejemplo, la energía de ionización, pero se puede determinar de manera indirecta efectuando cálculos a partir de otras propiedades atómicas o moleculares.
Se han propuesto distintos métodos para su determinación y aunque hay pequeñas diferencias entre los resultados obtenidos todos los métodos muestran la misma tendencia periódica entre los elementos.
El procedimiento de cálculo más común es el inicialmente propuesto por Pauling. El resultado obtenido mediante este procedimiento es un número a dimensional que se incluye dentro de la escala de Pauling. Esta escala varía entre 0,7 para el elemento menos electronegativo y 4,0 para el mayor.
Es interesante señalar que la electronegatividad no es estrictamente una propiedad atómica, pues se refiere a un átomo dentro de una molécula y, por tanto, puede variar ligeramente cuando varía el "entorno[] de un mismo átomo en distintos enlaces de distintas moléculas. La propiedad equivalente de la electronegatividad para un átomo aislado sería la afinidad electrónica o electroafinidad.
Dos átomos con electronegatividades muy diferentes forman un enlace iónico. Pares de átomos con diferencias pequeñas de electronegatividad forman enlaces covalentes polares con la carga negativa en el átomo de mayor electronegatividad.

C.2.1- Orden de electronegatividad de los elementos
La electronegatividad (EN) de un elemento es una medida de la tendencia relativa de un átomo a atraer electrones hacia sí mismo cuando está combinado químicamente con otro átomo.
Los elementos con valores elevados de electronegatividad (no metales) suelen ganar electrones para formar aniones y los elementos con valores bajos de electronegatividad (metales), suelen perder electrones para formar cationes.
El orden de la electronegatividad creciente es: Na ˂ B˂ O˂ F
A pesar de que la escala de electronegatividad es un poco arbitraria podemos utilizarla con confianza razonable para hacer predicciones respecto al enlace químico. Dos elementos con electronegatividades muy distintas (un metal y un no metal) tienden a reaccionar entre sí para formar compuestos iónicos, y el elemento menos electronegativo le cede su (s) electrón (es) al elemento más electronegativo. Dos no metales con electronegatividad semejante tienden a formar enlaces covalentes entre sí. Es decir, comparten sus electrones. En este compartimento, el elemento más electronegativo atrae más a los electrones
C.3- Energía de ionización
es la energía necesaria para separar un electrón en su estado fundamental de un átomo, de un elemento en estado de gas.La reacción puede expresarse de la siguiente forma:
 .
.
Siendo 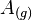 los átomos en estado gaseoso de un determinado elemento químico;
los átomos en estado gaseoso de un determinado elemento químico;  , la energía de ionización y
, la energía de ionización y  un electrón.
un electrón.

C.4- Afinidad electrónica
(AE) o electroafinidad se define como la energía liberada cuando un átomo gaseoso neutro en su estado fundamental (en menor nivel de energía) captura un electrón y forma un ion mononegativo:
 .
.
C.5- Elementos representativos
son los elementos de los grupos 1 y 2 (bloque s), y de los grupos de 13 a 18 (bloque p). Hasta hace unos años, estos grupos se identificaban con números romanos del I al VII con la letra A. Los elementos del grupo 12 son generalmente considerados como metales de transición, sin embargo, el zinc (Zn), el cadmio (Cd), y el mercurio (Hg) comparten algunas propiedades de ambos grupos, y algunos científicos creen que deben ser incluidos como elementos representativos o elementos de los grupos principales.

C.6- de transición y de transición interna.
Elementos de Transición: Estos elementos conforman los grupos IB hasta el VIIIB. Todos ellos son metales, pero debido a que sus átomos son pequeños, son duros, quebradizos y tienen puntos de fusión altos. Estos metales son buenos conductores del calor y de la electricidad. A condiciones normales el Mercurio es líquido.
Los elementos de transición llenan progresivamente su tercer nivel de energía hasta completarlo con 18 electrones; algunos de los elementos también ocupan el nivel 3d. Con excepción del Cromo y del Cobre, todos tienen dos electrones en el cuarto nivel (4s). Esta irregularidad ocurre en esos dos elementos ya que los sub niveles llenos y semillenos poseen una estabilidad adicional.
Los elementos del grupo B presentan varios estados de oxidación. Esto se debe a que todos los electrones de los niveles 3d y 4s los utilizan para formar enlaces químicos.
El Hierro, la Plata, el Cobre y el Oro, son elementos de transición que presentan características diferentes de los demás elementos que conforman la familia. Por eso son analizados por separado.
El Hierro se encuentra de formas múltiples en la naturaleza formando distintas aleaciones con otros elementos. Cuando el Hierro es puro, es casi blanco, compacto y blando. Químicamente es un metal muy activo y funciona con estados de oxidación +2 y +3. Cuando se expone a la humedad o al aire forma un óxido férrico hidratado. Por sus propiedades físicas, el Hierro es utilizado en la fabricación de herramientas y gran variedad de equipos.
En la naturaleza el Cobre se encuentra libre y combinado. Es un metal rojizo, lustroso, maleable y es gran conductor tanto del calor como de la electricidad. El estado de oxidación cuando forma compuestos es +1 y +2. Por la gran cantidad de usos que se le pueden dar, el Cobre es considerado como el segundo metal en importancia después del Hierro. El Cobre entra en la producción de muchas aleaciones en la que aporta resistencia, dureza, resistencia a la corrosión y propiedades valiosas para trabajos mecánicos.
La Plata se encuentra en la naturaleza en estado metálico y es el más blanco de todos los metales. Después del Oro, la Plata es el metal mas maleable y dúctil de los metales y es el mejor conductor de la electricidad. Cuando forma compuestos su número de oxidación es +1. Principalmente es utilizado en la fabricación de monedas y en la puntas de los instrumentos eléctricos.
En la naturaleza el Oro se encuentra libre. En estado masivo es amarillo, pero en forma pulverizada es bronceado. Es el más maleable y más dúctil de todos los metales. Es blando y se considera como uno de los más inertes. En estado de oxidación +1 forma compuestos aurosos y cuando su oxidación es +3 forma compuestos áuricos. El Oro se utiliza en el trabajo de la orfebrería de joyas y ornamentos. Su pureza es medida en Kilates o en grados de ley.
Los elementos de Z= 58 a Z=71 son elementos de transición interna y su característica es el llenado gradual de los orbitales 4f. Junto con el Lantano (Z= 57) que se les parece mucho, forman el grupo de los Lantánidos. Estos metales se encuentran principalmente como óxidos y se dividen en dos grupos: el Cerio Z= 57-62, y el Itrio Z=39. 63-71. Los óxidos Lantánidos se emplean extensamente en materiales fosforescentes para la televisión.
La gran similitud entre las propiedades de los Lantánidos se debe a que las diferencias entre sus configuraciones electrónicas se encuentran esencialmente en los orbitales f de una capa interna (n=4), en la que sus electrones tienen un papel secundario en la formación de enlaces. El estado de oxidación más común en sus compuestos es +3.
Los elementos desde el Protactinio (Z=90) hasta el Laurencio (Z=103) se conocen como actínidos. Todos son de transición interna ya que tienen orbitales 5f parcialmente ocupados. Debido a que los elementos ubicados más allá del Uranio (Z=92) deben ser "hechos por el hombre" (ya que sus núcleos se desintegran rápidamente por ser tan pesados), es muy difícil determinar sus propiedades físicas y químicas. Por eso, lo único que se ha podido determinar es que son metálicos y que su comportamiento químico es bastante similar al de los Lantánidos.

Elementos de transición interna: Los elementos de transición interna o elementos del bloque f (por tener sus electrones de valencia en el orbital f) son dos series, una comenzando a partir del elemento lantano y la otra a partir del actinio, y por eso a los
elementos de estas series se les llama lantánidos y actínidos. Aunque en la tabla periódica de los elementos tendrían que estar después de esos dos elementos, se suelen representar separados del resto. También se conocen los Lantánidos como tierras raras.

C.7- Elementos metálicos, no metálicos y metaloides.
Elementos metálicos: La mayor parte de los elementos metálicos exhibe el lustre brillante que asociamos a los metales. Los metales conducen el calor y la electricidad, son maleables (se pueden golpear para formar láminas delgadas) y dúctiles (se pueden estirar para formar alambres). Todos son sólidos a temperatura ambiente con excepción del mercurio (punto de fusión =-39 ºC), que es un líquido. Dos metales se funden ligeramente arriba de la temperatura ambiente: el cesio a 28.4 ºC y el galio a 29.8 ºC. En el otro extremo, muchos metales se funden a temperaturas muy altas. Por ejemplo, el cromo se funde a 1900 ºC.
Los metales tienden a tener energías de ionización bajas y por tanto se oxidan (pierden electrones) cuando sufren reacciones químicas. Los metales comunes tienen una relativa facilidad de oxidación. Muchos metales se oxidan con diversas sustancias comunes, incluidos 02 Y los ácidos.
Se utilizan con fines estructurales, fabricación de recipientes, conducción del calor y la electricidad. Muchos de los iones metálicos cumplen funciones biológicas importantes: hierro, calcio, magnesio, sodio, potasio, cobre, manganeso, cinc, cobalto, molibdeno, cromo, estaño, vanadio, níquel.

Elementos No metálicos: Los no metales varían mucho en su apariencia no son lustrosos y por lo general son malos conductores del calor y la electricidad. Sus puntos de fusión son más bajos que los de los metales (aunque el diamante, una forma de carbono, se funde a 3570 ºC). Varios no metales existen en condiciones ordinarias como moléculas diatómicas. En esta lista están incluidos cinco gases (H2, N2, 02, F2 y C12), un líquido (Br2) y un sólido volátil (I2). El resto de los no metales son sólidos que pueden ser duros como el diamante o blandos como el azufre. Al contrario de los metales, son muy frágiles y no pueden estirarse en hilos ni en láminas. Se encuentran en los tres estados de la materia a temperatura ambiente: son gases (como el oxígeno), líquidos (bromo) y sólidos (como el carbono). No tienen brillo metálico y no reflejan la luz. Muchos no metales se encuentran en todos los seres vivos: carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre en cantidades importantes. Otros son oligoelementos: flúor, silicio, arsénico, yodo, cloro.

Elementos Metaloides: Junto con los metales y los no metales, los semimetales (también conocidos como metaloides) comprenden una de las tres categorías de elementos químicos siguiendo una clasificación de acuerdo con las propiedades de enlace e ionización. Se caracterizan por presentar un comportamiento intermedio entre los metales y los no metales. Pueden ser tanto brillantes como opacos, y su forma puede cambiar fácilmente. Generalmente, los metaloides son mejores conductores de calor y de electricidad que los no metales, pero no tanto como los metales. No hay una forma unívoca de distinguir los metaloides de los metales verdaderos, pero generalmente se diferencian en que los metaloides son semiconductores antes que conductores.
Son considerados metaloides los siguientes elementos:
Boro (B)
Silicio (Si)
Germanio (Ge)
Arsénico (As)
Antimonio (Sb)
Telurio (Te)
Polonio (Po)
Astato (At)
Dentro de la tabla periódica los metaloides se encuentran en línea diagonal desde el boro al astato. Los elementos que se encuentran encima a la derecha son no metales, y los que se encuentran debajo a la izquierda son metales.
Son elementos que poseen, generalmente, cuatro electrones en su última órbita. El silicio (Si), por ejemplo, es un metaloide ampliamente utilizado en la fabricación de elementos semiconductores para la industria electrónica, como rectificadores, diodos, transistores, circuitos integrados, microprocesadores, etc.

II.- El enlace químico
A.- Definición
Un enlace químico es la interacción física responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos.
Los químicos suelen apoyarse en la fisicoquímica o en descripciones cualitativas.
En general, el enlace químico fuerte está asociado en la transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos (que forman la mayor parte del ambiente físico que nos rodea) está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.
Las cargas opuestas se atraen, porque, al estar unidas, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.

A.1- Relación entre enlace químico y los electrones de valencia
Los electrones de valencia son los que se encuentran disponibles para los enlaces.
Los átomos tenderán a enlazarse para conseguir ser más estables.
La mayoría lo hace logrando el octeto, ocho electrones en su estructura pero otros se estabilizan con menos, ej: con dos, el Hidrogeno.

A.2- Símbolos de Lewis
Símbolo de Lewis de un elemento consiste de un símbolo químico que representa el núcleo de un átomo con sus electrones de las nubes electrónicas internas junto con unos puntos colocados alrededor del símbolo que representa los electrones de valencia, los electrones de la nube electrónica externa.
Cuando los electrones de valencia son transferidos de un átomo a otro, se forman iones que son mantenidos unidos electroestáticamente formando enlaces iónicos (compuestos iónicos) y su estructura Lewis es escrita con las cargas de sus iones y el desplazamiento de sus electrones. En otros casos, los electrones son compartidos en una manera que cada átomo adquiere una configuración electrónica de un gas noble, donde se completa el octeto (8 electrones de valencia en la nube electrónica externa) formando un compuesto covalente y se escribe compartiendo el par de electrones entre los átomos.

A.3- Regla del Octeto y Regla del Duplete.
-Regla del Octeto
Establece que los átomos de los elementos se enlazan unos a otros en el intento de completar su capa de valencia.
La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, o sea, el átomo queda estable cuando presenta en su capa de valencia 8 electrones.
Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar o perder electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia.

Regla de Dueto
Cuando se forma un enlace químico, los átomos reciben, ceden o comparten electrones de modo que el último nivel de energía de cada átomo contenga 8 electrones y así adquiera la configuración electrónica del gas noble más cercano en la tabla periódica.En el caso de los átomos de los elementos H, Li y Be, cuando establecen enlaces, tienden a completar su último nivel de energía con 2 electrones y alcanzar la configuración electrónica del gas noble helio (He). (Regla del dueto)
-Los elementos metálicos ceden electrones.
-Los elementos no metálicos ganan o comparten electrones.

A.4- Clasificación del enlace químico.
Un enlace químico es la interacción física responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos.
A.4.1 Enlace iónico o enlace electrocovalente
Las sustancias iónicas son sustancias que presentan enlaces iónicos y forman grandes redes cristalinas. Los enlaces iónicos se producen cuando en un enlace covalente, la
diferencia de electronegatividad entre un átomo y otro es muy grande y suponemos que el par de electrones de enlace está en el átomo más electronegativo. De tal forma que se producen iones positivos y negativos. Este tipo de enlace se da fundamentalmente entre metales y no metales. Estas sustancias son, por ejemplo, el bicarbonato de sodio, el cloruro de potasio y el trisulfuro de aluminio II.
Las propiedades que se dan en este tipo de sustancias son: Sólidos cristalinos, puntos de fusión y ebullición elevados, solubles en agua, Conducen la electricidad fundidos o en disolución, pero no conducen la electricidad en estado sólido.

A.4.2- Enlace covalente
Las sustancias covalentes son aquellas que presentan enlaces covalentes entre sus átomos y se presentan en forma de grandes redes tridimensionales, como por ejemplo el carbono diamante y el carbono grafito.
El enlace covalente es aquel que se produce cuando los electrones de la última capa de un átomo son atraídos por el núcleo de otro átomo, y lo mismo ocurre con el segundo átomo. Los átomos se acercan hasta que alcanzan un equilibrio en el que las fuerzas de atracción nucleo-electrón y las fuerzas de repulsión núcleo-núcleo y electrón-electrón se equilibran. Se produce un solapamiento de los orbitales atómicos de la última capa. Las propiedades de este tipo de sustancias son: Sólidos, puntos de fusión y ebullición elevados. La solubilidad y la conductividad varían de una sustancia a otra.

A.4.3- Enlace metálico
Son aquellas que presentan un solo elemento, que forman grandes redes metálicas, donde los electrones de la capa de valencia están deslocalizados moviéndose por todo la sustancia, de esta forma, una nube de electrones recubre la sustancia y le da ese característico brillo metálico. Algunas de estas sustancias son el hierro, el sodio y el potasio.
Las propiedades de estas sustancias son: Sólidos, dureza variada. Puntos de fusión y ebullición también muy variados, insolubles en agua y característico brillo metálico.

A.- 4.4 Enlace molecular
Son aquellas sustancias que presentan enlaces covalentes, pero que en lugar de formar macromoléculas, forman moléculas discretas, como es el caso del agua, del carbono fulereno y del amoniaco. Las propiedades que presentan este tipo de moléculas son: Son, fundamentalmente, líquidos y gases. Tienen puntos de fusión y ebullición bajos. No conducen la electricidad y son insolubles en agua.

